روى أميركيان كانا يعانيان من فقر الدم المنجلي قصة كفاحهما وتخلصهما من سنوات طويلة من الألم، بعد تلقيهما علاجات جينية مبتكرة، حظيت مؤخراً على تراخيص من السلطات الصحية في الولايات المتحدة.
ويأمل المريضان السابقان، ويدعيان تيشا صامويلز وجيمي أولاجير، في رفع مستوى الوعي بهذه العلاجات الجينية، حتى يتمكن الآخرون من استخدامها، خصوصاً وأن كلفتها قد تصل إلى 3.1 مليون دولار للشخص الواحد.
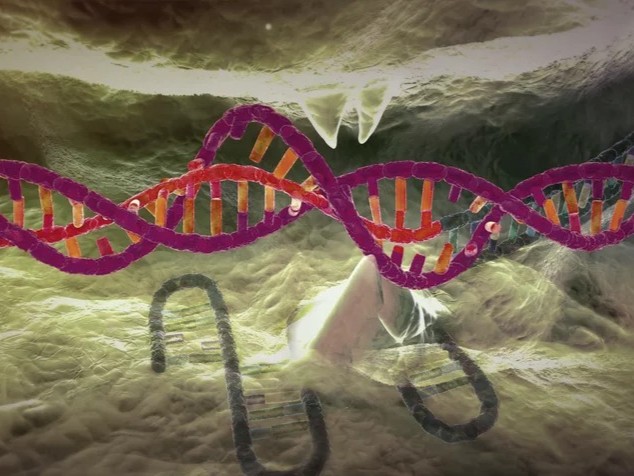
والمرضى الذين يعانون من مرض فقر الدم المنجلي لديهم طفرة تؤثر على الهيموجلوبين، وهو بروتين يحمل الأكسجين في خلايا الدم الحمراء، التي تأخذ بعد ذلك شكلاً منجلياً، ما يحد من تدفق الدم وتوصيل الأكسجين.
وفقر الدم المنجلي هو مرض وراثي يصيب حوالى 100 ألف شخص في الولايات المتحدة و20 مليون شخص في جميع أنحاء العالم، إذ يؤثر بشكل رئيسي على ذوي البشرة السمراء، إذ يعزي العلماء أحد الأسباب في ذلك هو أن سمة الخلية المنجلية تحمي من الملاريا.
علاج "ليفجينيا"
ووُلدت تيشا صامويلز في عام 1982، قبيل بدء فحوصات حديثي الولادة لفقر الدم المنجلي، لكن إصابتها شُخصت في سن الثانية. وفي السابعة من عمرها، عانت من نوبة خطيرة من فقر الدم، وفي سن الـ 13، أجبرتها سكتة دماغية على الخضوع لعمليات نقل دم شهرية.
وعندما أصبحت صامويلز شابة بالغة، فقدت صديقاً لها كان محارباً لمرض فقر الدم المنجلي، وغالباً ما كان ينتهي به الأمر في المستشفى نفسه الذي كانت تُعالَج فيه.
وتابعت الشابة دراستها في جامعة "هوارد" المرموقة، آملة في أن تصبح طبيبة، لكنها اضطرت إلى ترك الدراسة بسبب مرضها، قائلة إن المرض "دفعها إلى التخلي عن الأحلام".
وبعد زواجها في سن مبكرة، كانت تيشا تحتاج إلى 8 ساعات من الحقن كل ليلة، لكن في عام 2018، اتخذت حياتها منعطفاً جديداً، فقد أصبحت من أوائل الذين تلقوا علاجاً تجريبياً آنذاك.
وهذا العلاج الذي يُسوّق حالياً باسم "ليفجينيا" Lyfgenia، يستخدم فيروساً غير ضار لحمل نسخة صحية من الجين الذي ينتج الهيموجلوبين إلى الخلايا.
ويجمع الأطباء أولاً الخلايا الجذعية للمريض، ثم يأتي الجزء الصعب، المتمثل بإزالة الخلايا الجذعية من الحبل الشوكي للمريض من طريق العلاج الكيميائي، ما يفسح المجال للخلايا المعدّلة.
وفقدت تيشا شعرها ودخلت المستشفى بسبب نزف في الأنف استمر 16 ساعة، ثم استعادت طاقتها، قائلة إن الأمر "أشبه بالعودة إلى الحياة".
وتستغرق الصفائح الدموية أشهراً لتعود إلى وضعها الطبيعي، إذ يخضع كل مريض مشارك في التجربة السريرية لمتابعة تستمر 15 عاماً.
مقص "كريسبر"
ولدى الشاب جيمي أولاجير (38 عاماً)، خلفية مماثلة، إذ تعود ذكرياته الأولى عن مرضه عندما كان في الثامنة من عمره، حينها كان يلعب كرة القدم في نيجيريا، موطنه الأصلي، لكنه كان يُضطر للتوقف كل 5 دقائق للراحة والشرب.
وبعد مدة، أرسله والداه للعيش مع عمته في نيوجيرسي بالولايات المتحدة، حيث كانت الرعاية الصحية أفضل، لكنه عاش طفولة صعبة، إذ فشل في إكمال دراسته واضطر إلى إزالة المرارة وأصيب بنوبة قلبية.
وفي أسوأ حالاته، كان يمضي 80% من وقته في السرير، لكن انتقاله إلى أتلانتا، حيث الجو أكثر دفئاً، ساعده، كما الحال بالنسبة للكثير من مرضى فقر الدم المنجلي.
وفي العام 2019، عندما سمع عن تجربة سريرية باستخدام مقص "كريسبر" الجزيئي، سجل نفسه ووصلته رسالة "سحرية" تنبئه بقبوله لهذه التجربة.
وبفضل الخلايا الجذعية المعدلة التي يتلقاها مع هذا العلاج المسمى "كاسجيفي" Casgevy، بات جيمي الآن "يعيش حلماً". وأصبح أباً لـ3 أطفال، بفضل التخصيب في المختبر، كما يدير شركات صغيرة عدة، حيث يسعى إلى تعميم هذا العلاج، خصوصاً في إفريقيا، حيث لا يزال الوصول إليه بمثابة "حلم بعيد المنال".
وقال جون تيسدال من المعاهد الأميركية للصحة (NIH)، الذي قاد التجربة التي شاركت فيها تيشا صامويلز، إن الخطوة التالية هي جعل العلاج أقل عبئاً وكلفة على المرضى، مشيراً إلى وجود ضبابية بشأن تغطية هذه العلاجات الجينية عن طريق التأمين الصحي الخاص، لكن برنامج "ميديكايد" Medicaid العام أعلن أنه سيغطي هذه التكاليف بدءاً من العام المقبل.