تَمكّن باحثون من جامعة "كيس ويسترن ريزيرف" الأميركية من اكتشاف مركّبين جديدين قد يكونان قادرين على علاج التهاب الشبكية الصباغي، وهو مجموعة من الأمراض الوراثية التي تؤدي إلى فقدان البصر التدريجي.
وتتسبب الطفرات الوراثية التي تعطل طي البروتينات في مجموعة من الأمراض المعروفة بأمراض التشكل البروتيني والتي تصيب البروتينات الغشائية، بما في ذلك المستقبلات المقترنة بالبروتين والتي تصبح عُرْضة بشكل خاص للطي غير الصحيح.
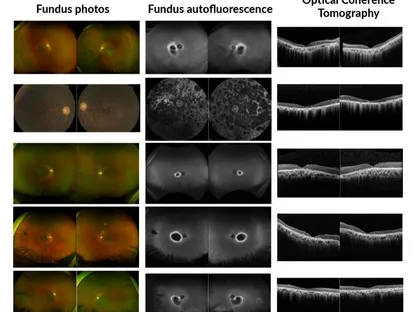
ويعاني مرضى التهاب الشبكية الصباغي من تحورات جينية تؤدي إلى طي غير طبيعي لبروتين "الرودوبسين" في الشبكية، مما يتسبب في موت خلايا الشبكية تدريجياً وفقدان البصر.
يوجد "الرودوبسين"، وهو بروتين غشائي، في خلايا العصي في الشبكية، ويُعدّ أساسياً في عملية الرؤية، حيث يستجيب للضوء ويساعد في تحويل الإشارات الضوئية إلى إشارات عصبية يتم إرسالها إلى الدماغ.
وقد تؤدي الطفرات الوراثية في جين "الرودوبسين" إلى اضطرابات في طي البروتين بشكل صحيح داخل الخلايا، مما يعيق نقل الضوء بشكل فعال ويؤدي إلى مشاكل في الرؤية.
أمراض مرتبطة بطفرات الرودوبسين
ومن أبرز الأمراض المرتبطة بطفرات الرودوبسين هو مرض "الضمور البقعي المرتبط بالوراثة"، أو "التنكس الشبكي الصباغي" الذي يُعتبر من أبرز أسباب العمى الوراثي.
في هذه الحالة، تؤدي الطفرات في الجين إلى تشكيل بروتينات رودوبسين مشوهة أو غير مستقرة، ما يؤدي إلى تراكم البروتينات غير المطوية بشكل صحيح في الشبكية وتدهور الخلايا العصوية، ما يؤدي بدوره إلى تدهور القدرة على الرؤية الليلية ثم فقدان الرؤية المحيطية، وفي بعض الحالات، قد يتطور إلى العمى الكامل.
وتكمن العلاقة بين الرودوبسين والمرض في أن الطفرات الجينية في بروتين الرودوبسين تساهم في آلية المرض بشكل رئيسي من خلال تأثيرها على قدرة الخلايا على معالجة الضوء، مما يعزز فهم الآلية التي تؤدي إلى الأمراض المرتبطة به، ويساعد في تطوير استراتيجيات علاجية محتملة لتحسين فاعلية البروتين المشوَّه أو تعزيز استقراره داخل الخلايا.
وبينما تعتمد العلاجات التجريبية الحالية على "مركّبات الريتينويد"، مثل مشتقات فيتامين A الصناعية، التي تعاني من حساسية للضوء وتسبب آثاراً جانبية سامة، مما يحد من فاعليتها.
تعتمد العلاجات التجريبية الحالية على مجموعة من المواد المعروفة باسم "مركّبات الريتينويد" لتحسين طي البروتينات الغشائية مثل الرودوبسين، لكنها تعاني من عدة مشكلات تحد من فاعليتها العلاجية.
وتشمل هذه المشكلات الحساسية للضوء، حيث تتدهور تركيبتها الكيميائية عند التعرض للضوء، والتفاعل الكيميائي مع الجزيئات الأخرى مما قد يؤدي إلى نواتج تفاعلية ضارة أو غير فعالة.
كما تعاني من ضعف الثبات الكيميائي، مما يجعل استخدامها كعلاج طويل الأمد صعباً؛ نظراً لتحللها السريع في الجسم، ويتطلب ذلك تكرار الجرعات أو تطوير مركّبات أكثر استقراراً.
وتسبب بعض مركّبات الريتينويد آثاراً جانبية مثل تهيج الجلد، والجفاف، والحساسية المفرطة للضوء، مما يستدعي مراقبة دقيقة عند استخدامها، لذلك هناك حاجة لتطوير مركّبات بديلة غير ريتينويدية تتميز بفاعلية واستقرار أكبر مع تقليل التفاعل الكيميائي والآثار الجانبية، لتحقيق استخدام آمن وفعّال في العلاجات المختلفة.
فحص افتراضي
في الدراسة المنشورة في مجلة "بلوس بيولوجي" (PLOS Biology)، استخدم الباحثون الفحص الافتراضي للبحث عن جزيئات دوائية جديدة يمكنها الارتباط ببروتين الرودوبسين وتثبيت هيكله لتحسين طيه وحركته داخل الخلية.
تم تحديد مركّبين غير ريتينويديين يمتلكان القدرة على عبور الحاجز الدموي الدماغي وحاجز الشبكية.
وأظهرت التجارب المخبرية أن هذه المركّبات حسنت من تعبير الرودوبسين على سطح الخلية في 36 من أصل 123 نوعاً جينياً من التهاب الشبكية الصباغي، بما في ذلك النوع الأكثر شيوعاً. كما ساعدت المركّبات في حماية خلايا الشبكية من الانحلال في الفئران المصابة بالمرض.
وأشار الباحثون إلى أن العلاج بأحد المركّبين حسَّن من صحة ووظيفة الشبكية بشكل عام في الفئران، حيث أدى إلى إطالة عمر خلايا المستقبلات الضوئية. ومع ذلك، أكدوا على الحاجة إلى مزيد من الدراسات حول هذه المركّبات أو مركّبات مشابهة قبل اختبار العلاجات على البشر.
وأكدت الدراسة أن الطفرات الوراثية في جين الرودوبسين هي السبب وراء التهاب الشبكية الصباغي، الذي يُعد مرضاً تدريجياً يؤدي إلى فقدان البصر ولا يوجد له علاج حالي.
ويُعتبر هذا البحث خطوة نحو تقديم نهج علاجي جديد يهدف إلى منع فقدان البصر لدى المرضى.