توصل فريق من العلماء الكنديين إلى آلية بيولوجية غير متوقعة يمكن من خلالها إبطاء نمو الورم الأرومي الدبقي، وهو أكثر أورام الدماغ شراسة ومقاومة للعلاج، مع تحديد دواء مستخدم بالفعل في علاج فيروس نقص المناعة البشرية بوصفه مرشحاً محتملاً لإعادة التوظيف العلاجي في هذا السياق.
وتكشف الدراسة، المنشورة في دورية Neuron، عن شبكة تواصل خفية داخل الدماغ تسهم بشكل مباشر في دعم الورم وتسريع نموه وانتشاره، ما يغير فهماً راسخاً لطبيعة هذا المرض المعقد.
لطالما اعتبر الورم الأرومي الدبقي تحدياً استثنائياً في علم الأورام العصبية. فبرغم التقدم الكبير في الجراحة والعلاج الإشعاعي والكيميائي، لا يزال متوسط البقاء على قيد الحياة بعد التشخيص يقاس في الغالب بالأشهر لا بالسنوات.
ويرجع ذلك إلى قدرة الورم العالية على غزو أنسجة الدماغ المحيطة، وتكيفه السريع مع العلاجات، واحتوائه على خلايا جذعية سرطانية قادرة على إعادة بناء الورم حتى بعد استئصال أجزاء كبيرة منه.
وتنطلق الدراسة الجديدة من فرضية محورية مفادها أن الورم الأرومي الدبقي لا يتصرف ككتلة معزولة من الخلايا السرطانية، بل كنظام بيئي متكامل يتفاعل مع الخلايا الطبيعية المحيطة به ويستغلها لصالحه.
ويضم هذا "النظام البيئي السرطاني" خلايا عصبية، وخلايا مناعية، وخلايا دبقية، تعمل جميعها – بوعي أو بدونه – على توفير بيئة مثالية لنمو الورم.
نقاط ضعف
وتقول المؤلفة الأولي للدراسة شيلا سينج، الأستاذة في الجراحة بجامعة ماكماستر الكندية، إن الورم الأرومي الدبقي ليس مجرد تجمع من الخلايا الخبيثة، بل منظومة كاملة من التفاعلات الخلوية "حين نفهم كيف تتواصل هذه الخلايا، يمكننا اكتشاف نقاط ضعف لم تكن مرئية من قبل".
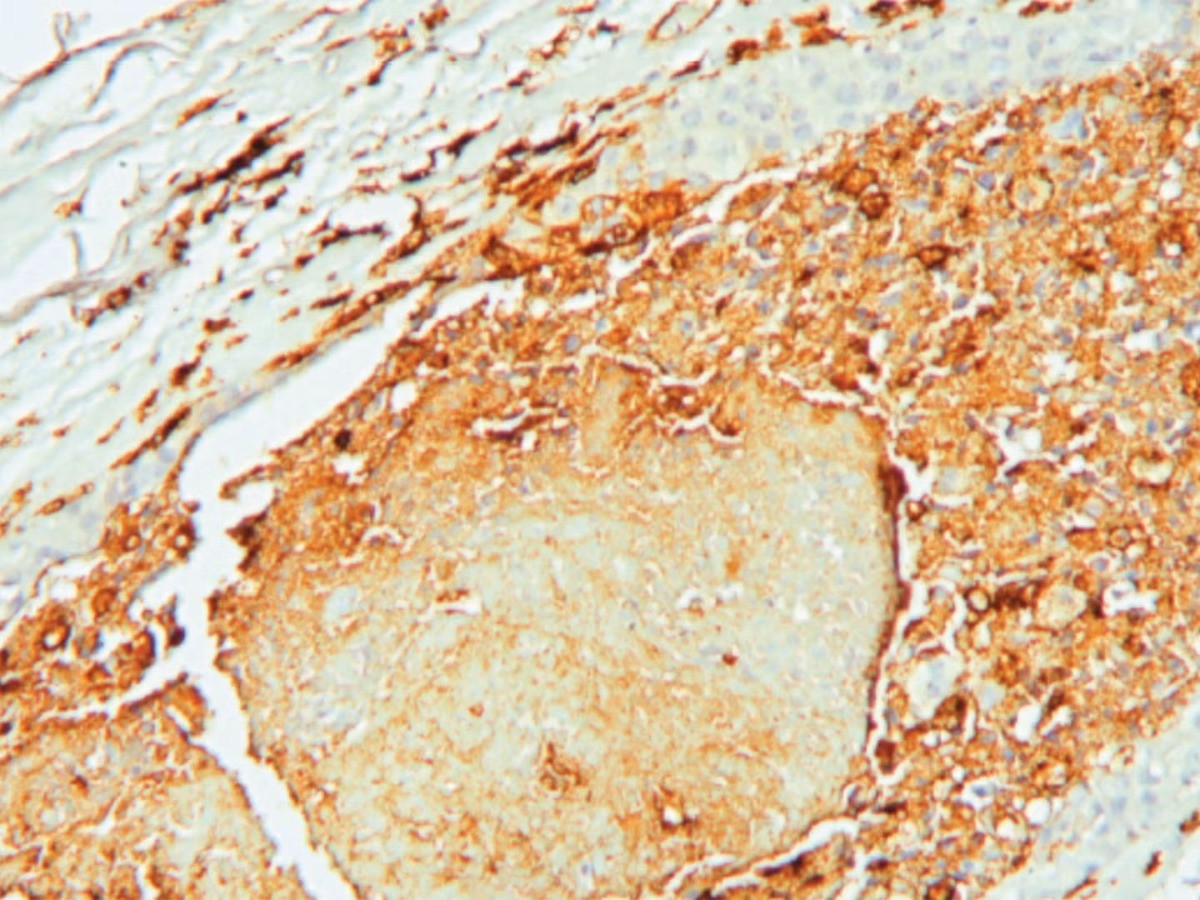
وركز الباحثون في دراستهم على نوع محدد من خلايا الدماغ يعرف باسم الخلايا قليلة التغصن، وهذه الخلايا معروفة بدورها الحيوي في حماية الألياف العصبية عبر تكوين غلاف الميالين، الذي يسمح بنقل الإشارات العصبية بسرعة وكفاءة.
ولعقود، اعتبرت هذه الخلايا جزءاً من "الدعم اللوجستي" للجهاز العصبي، بلا دور مباشر في تطور السرطان.
غير أن نتائج الدراسة قلبت هذا التصور رأساً على عقب. فقد أظهرت البيانات أن الورم الأرومي الدبقي قادر على "إعادة برمجة" هذه الخلايا الداعمة، ودفعها إلى لعب دور نشط في دعم الورم. إذ تستجيب الخلايا قليلة التغصن لإشارات يطلقها الورم، وتتحول إلى حالة تفاعلية شبيهة بتلك التي تظهر في حالات الالتهاب العصبي أو إصابات الدماغ الرضحية.
وفي هذه الحالة التفاعلية، تبدأ الخلايا بإفراز جزيئات كيميائية -سيتوكينات- تعزز بقاء الخلايا السرطانية وتزيد من قدرتها على الانقسام والانتشار.
واعتمد الفريق البحثي على مجموعة متقدمة من التقنيات الحديثة، شملت التحليل الجيني أحادي الخلية، والنسخ المكاني للجينات داخل أنسجة الورم، والفحوص النسيجية المناعية، إضافة إلى نماذج حيوانية وتجارب مخبرية دقيقة.
وقد مكن هذا النهج المتكامل الباحثين من رسم خريطة تفصيلية للتفاعلات بين الخلايا السرطانية والخلايا قليلة التغصن.
تنشيط مستقبل
وأظهرت النتائج أن الورم يجذب هذه الخلايا إلى أطرافه عبر مسار إشاري يعرف باسم الفراكتالكين، وبعد استقرارها في محيط الورم، تدخل الخلايا قليلة التغصن في حالة تفاعلية محفزة بالإنترفيرون، وتبدأ بإفراز جزيئات تعزز نمو الورم، وعلى رأسها جزيئات جذب مناعية تعرف باسم CCL5.
هذه المادة تعمل بدورها على تنشيط مستقبل خاص يدعى CCR5، وهو مستقبل يوجد بكثافة على سطح الخلايا الجذعية السرطانية في الورم الأرومي الدبقي، خاصة في الحالات المتقدمة أو عند عودة الورم بعد العلاج.
وتكمن الأهمية الاستثنائية لهذا الاكتشاف في أن مستقبل CCR5 ليس غريباً على الطب الحديث، إذ يعد هدفاً معروفاً في علاج فيروس نقص المناعة البشرية، حيث يستخدم الفيروس CCR5 للدخول إلى خلايا الجهاز المناعي.
ولتعطيل هذه الآلية، تم تطوير دواء "مارافيروك"، المعتمد منذ سنوات ويستخدم على نطاق واسع في علاج بعض حالات نقص المناعة HIV.
وأظهرت الدراسة أن تعطيل مستقبل CCR5 – سواء عبر تقنيات التعديل الجيني أو باستخدام مارافيروك – أدى إلى إضعاف خصائص "الجذعية" في الخلايا السرطانية، وأبطأ نمو الورم، وأطال فترة البقاء على قيد الحياة في النماذج الحيوانية للمرض.
ويقول المؤلف المشارك في الدراسة جيسون موفات، رئيس برنامج علم الوراثة وعلم الجينوم في مستشفى "سيك كيد" الكندية، إن "البيئة الخلوية داخل الورم الأرومي الدبقي أكثر ديناميكية وتعقيداً مما كنا نعتقد، وبتحديد هذا المسار الإشاري، لم نكتشف فقط جزءاً أساسياً من بيولوجيا المرض، بل حددنا أيضاً هدفاً علاجياً يمكن التعامل معه بدواء موجود بالفعل”.
وعادة ما يستغرق تطوير دواء جديد لعلاج السرطان سنوات طويلة، إن لم يكن عقوداً، من البحث والتجارب السريرية. أما إعادة توظيف دواء معتمد، فيعد اختصاراً مهماً لهذا المسار، إذ تكون بيانات السلامة والجرعات والآثار الجانبية متوفرة مسبقاً.
تفاؤل حذر
وفي حالة الورم الأرومي الدبقي، حيث الخيارات العلاجية محدودة للغاية والوقت عامل حاسم، يمثل هذا الاحتمال بارقة أمل حقيقية. فبدل البدء من نقطة الصفر، يمكن للباحثين الانتقال بسرعة أكبر إلى تجارب سريرية تهدف إلى اختبار فعالية مارافيروك في المرضى.
ورغم التفاؤل الكبير الذي أثارته النتائج، يشدد باحثون على أن الطريق ما زال طويلاً قبل اعتماد أي علاج جديد بشكل روتيني. فالتجارب السريرية على البشر ضرورية للتأكد من فعالية الدواء وسلامته في سياق سرطان الدماغ، خاصة أن بيئة الدماغ تختلف عن باقي أنسجة الجسم، ويعد الحاجز الدموي الدماغي تحدياً إضافياً أمام وصول الأدوية.
مع ذلك، يتفق خبراء على أن الدراسة تمثل تقدماً نوعياً في فهم الورم الأرومي الدبقي، وتؤكد أن استهداف "النظام البيئي" للورم قد يكون مفتاحا لإضعافه.